동정보이차 춘추차관
뱀독 인 인산분해효소 A 2 에 의해 유도된 효소 및 세포독성 활성에 대한 식물 페놀 화합물의 억제 효과
Vitae vol.18 no.3 Medellín 9월/12월 2011년
약리학 및 독성학
뱀독 인 인산분해효소 A 2 에 의해 유도된 효소 및 세포독성 활성에 대한 식물 페놀 화합물의 억제 효과
EFECTOS INHIBITORIOS DE COMPUESTOS FENÓLICOS DE PLANTAS SOBRE LA ACTIVIDAD ENZIMATICA Y CITOTOXICA INDUCIDA POR UNA FOSFOLIPASA A 2 DE VENENO DE SERPIENTE
Jaime A. PEREAÑEZ 1* ; 비텔비나 누에즈 1,2 ; Arley C. PATIÑO 1 ; 모니카 론두오 1 ; 후안 C. 퀸타나 1
1 Programa de Ofidismo/Escorpionismo. Universidad de Antioquia. AA 1226. 콜롬비아 메데인.
2 Escuela de Microbiology. Universidad de Antioquia. AA 1226. 콜롬비아 메데인.
* 해당 작성자: andres.pereanez@siu.udea.edu.co .
접수: 2010년 2월 23일 접수:
2011년 4월 25일
요약
폴리페놀 화합물은 뱀독 단백질에 의해 유발되는 독성 효과를 억제하는 것으로 나타났습니다. 이 연구에서 우리는 갈산, 페룰산, 카페산, 프로필갈레이트 및 에피갈로카테킨갈레이트가 난황을 기질로 사용하여 포스포리파제 A 2 (PLA 2 )의 효소 활성을 억제한다는 것을 보여줍니다. IC50 값은 0.38 – 3.93mM입니다. 이러한 폴리페놀 화합물은 또한 합성 기질이 사용될 때 PLA 2 효소 활성을 억제합니다. 또한, 이러한 화합물은 근독성 PLA 2 에 의해 유도된 세포독성 효과를 감소시켰습니다.; 구체적으로, epigallocatechin gallate는 90.92 ± 0.82%로 가장 좋은 억제능을 보였고, ferulic acid는 30.96 ± 1.42%로 가장 낮은 억제능을 나타냈다. 페놀 화합물의 가능한 작용 방식을 결정하기 위해 분자 도킹 연구가 수행되었습니다. 모든 폴리페놀은 효소의 활성 부위와 수소 결합을 보였다. 또한, epigallocatechingallate는 다른 화합물과 비교하여 가장 강한 결합을 나타냈다. 또한 예비 구조-활성 관계 분석에서 IC50과 각 화합물의 토폴로지 극성 표면적(p = 0.0491, r = -0.8079(-0.9878~-0.2593)) 간의 상관관계가 나타났으며, 이는 각 화합물에 필요한 표면적을 나타냅니다. 대부분의 효소와 결합하는 분자. 뿐만 아니라, 우리의 결과는 프로필갈레이트와 에피갈로카테킨갈레이트가 항근육독성 잠재력을 가진 두 가지 새로운 천연 제품임을 보여줍니다. 물린 부위에 이러한 식물성 폴리페놀을 국소 적용하면 근독성을 예방할 수 있습니다. 그러나, 더 나아가시험관 내 결과를 확인하려면 생체 내 연구가 필요할 것 입니다.
핵심어: 뱀에 물림, 페놀 화합물, 국소 조직 손상, 포스포리파제 A 2 , 분자 도킹.
이력서
Los compuestos fenólicos han Mostrado inhibir los efectos tóxicos inducidos por proteínas de veneno de Serpiente. En éste trabajo, nosotros demostramos que el ácido gálico, el ácido ferúlico, el ácido cafeico, el propilgalato y el epigalocatequingalato inhiben la actividad enzimática de una fosfolipasa A 2 ema 2 ( PLA ) Los valores de IC50 están entre 0,38 – 3,93mM. Los compuestos mencionados también inhiben la actividad enzimática cuando un sustrato sintético es usado. Además, estos compuestos polifenólicos disminuyen el efecto citotóxico inducido por la fosfolipasa A 2miotóxica, el epigalocatequingalato exhibe la mejor capacidad inhibitoria con 90,92 ± 0,82%, mientras que el ácido ferúlico muestra la menor actividad inhibitoria con 30,96 ± 1,42%. Con el fin de determinar los posibles mecanismos de acción de los compuestos fenólicos, realizamos estudios de modelamiento molecule. Todos los polifenoles muestran puentes de hidrogeno con el sitio activo de la enzima; además el epigalocatequingalato presenta una unión más fuerte con la PLA 2que los otros compuestos. Adicionalmente, un análisis preliminar de relación estructura actividad muestra una correlación entre los valores de IC50 y el área 표면 극지 지형 (p = 0,0491, r = -0,8079 (-0,98), la = -0,8079 (-0,98) cual indica el área superficial requerida por cada molécula para unirse a la enzima. Además, nuestros resultados muestran al propilgalato y el epigalocatequingalato como dos nuevos productos naturales con potencial antimiotóxico. La aplicación tópica de estos polifenoles en el sitio de mordedura podría llevar a la prevención de la miotoxicidad; 죄 금수 조치, 사후 조사 생체 외 조사 결과에 대한 사후 조사 .
팔라브라스 클레이브: Accidente ofídico, compuestos fenólicos, daño tisular local, fosfolipasa A 2 , modelamiento molecule.
키워드: 알파.
소개
뱀에 물린 것은 세계의 많은 지역, 특히 아프리카, 아시아, 라틴 아메리카 및 오세아니아의 열대 및 아열대 국가에서 관련 공중 보건 문제를 나타냅니다(1). 뱀뱀에 물렸을 때 관찰되는 병태생리학적 효과는 여러 효소, 단백질 및 펩티드의 작용을 결합합니다. 여기에는 포스포리파제 A 2 , 출혈성 메탈로프로테아제 및 기타 단백질 분해 효소, 응고제 성분, 신경독, 세포독 및 심장독이 포함됩니다(2). 포스포리파제 A 2 (PLA 2 ; EC 3.1.1.4)는 인지질의 가수분해에 중요한 작용을 하는 뱀의 독에 많이 존재하는 효소입니다. PLA 2 는 또한 부종, 혈소판 응집 조절, 신경독성, 항응고제 및 근독성 효과와 같은 여러 약리학적 효과를 유발할 수 있습니다(3, 4). 특정 PLA에 대한 조직의 감수성을 설명하려면 2효소, 표적 세포의 표면에 ''표적 부위''의 존재가 제안되었다(3). 이러한 표적 부위는 PLA의 특정 ''약리학적 부위''에 의해 인식됩니다.이러한 표적 부위는 PLA 2 분자이러한 약리학적 부위는 효소의 활성 부위와 독립적이지만 때로는 겹치기도 합니다(3).
근독성 PLA 2 s는 지질 또는 단백질일 수 있고 PLA 2 s 에 대한 친화도가 다를 수 있는 원형질막(표적 부위)의 수용체에 결합합니다 . 결합 시, 근독성 PLA 2 s는 촉매 의존성(인지질 가수분해) 또는 독립적인 메커니즘(약리학적 부위와 세포막의 상호작용)에 의해 원형질막의 완전성을 파괴합니다. 결과적으로 이온 및 거대분자에 대한 투과성 제어에 손실이 있습니다. 가장 중요한 사건은 현저한 Ca 2+ 유입이며, 이는 원형질막의 과수축 및 기계적 손상, 칼페인 및 세포질 Ca 2+ 활성화와 관련된 일련의 복잡한 퇴행성 사건을 시작합니다. 의존성 PLA 2 s, Z 라인 손실 및 미토콘드리아 Ca 2+ 과부하(5). 이러한 현상은 빠르게 발생하여 근육 세포의 괴사를 유발합니다. 이 효과의 유도에서 촉매 활성의 역할은 특정 효소에 따라 다릅니다. 따라서 PLA 2 의 알킬화촉매 부위의 His48에 특이적으로 결합된 BPB는 효소 활성을 없애고 여러 약리학적 활성(항응고제, 근독성, 세포독성, 부종 형성)을 감소시켜 이 부위의 완전성에 의존함을 시사합니다. 그러나 다른 약리학적 활성에 대한 이러한 변형의 효과는 일부 효소의 경우 덜 현저합니다. 이러한 관찰은 다른 위치의 증거에도 불구하고 가수분해 활성이 일부 생물학적 효과에서 상당한 역할을 한다는 것을 시사합니다(6).
뱀에 물린 치료법은 말이나 양의 해독제를 정맥 주사하는 것을 기본으로 합니다(7). 그러나 이 치료법은 일반적으로 독의 국소 조직 손상 활동에 대해 제한된 효능을 가지고 있음이 입증되었습니다(8). 따라서, 기존의 해독제 치료를 보완하는 데 유용할 수 있는 억제제 및 접근법을 찾을 필요가 있습니다.
식물 추출물은 약리학적 활성 화합물의 풍부한 공급원을 구성하며, 그 중 일부는 다양한 조독 및 정제된 독소의 활성을 길항하는 대안으로 보고되었습니다(9-11). 그러나 이러한 화합물 중 일부만이 분리되어 활성 성분으로 확인되었습니다(12-14). 이들 화합물에서 상당한 수의 폴리페놀(15-17)이 분류되었으며, 이는 분자당 하나 이상의 페놀 단위가 존재하는 것을 특징으로 하는 식물 및 미생물에서 발견되는 화학 물질 그룹입니다. 폴리페놀은 일반적으로 가수분해성 탄닌(포도당 및 기타 당의 갈산 에스테르)과 리그닌, 플라보노이드 및 축합 탄닌과 같은 페닐프로파노이드로 구분됩니다.
따라서 이 연구의 목적은 뱀 독 PLA 2 의 효소 및 세포 독성 활성에 대한 다음 페놀 화합물의 억제 능력을 입증하는 것이었습니다 : 갈산, 페룰산, 카페산, 프로필갈레이트 및 에피갈로카테킨갈레이트( 그림 1 참조)의 페놀 화합물의 억제 능력을 입증하는 것이었습니다. 이를 위해 우리 는 크로톡신 복합체(콜롬비아에서 분리된 CB)의 PLA 2 에 대한 이러한 화합물의 억제 능력을 테스트했습니다. 방울뱀) . 이 독소는 이 종에 의해 가해지는 뱀에 물린 신경독성 및 국소/전신 근독성 효과를 담당합니다. 이들 화합물의 가능한 작용 방식을 결정하기 위해; 우리는 분자 도킹 연구와 예비 구조-활성 관계 분석을 수행했습니다. Crotalus durissus cumanensis
재료 및 방법
화학물질 및 시약
Caffeic acid, ferulic acid, propylgallate, gallic acid, tannic acid, epigallocatechingallate는 Sigma에서 구입하여 추가 정제 없이 사용하였다. 모든 경우에, 화합물을 PBS 중 3% DMSO에 희석하였다. 이 작업에 사용된 다른 시약은 Sigma 및 Merck에서 구입했으며 순도 수준이 가장 높았습니다. 탄닌산이 단백질을 침전시키는 능력과 뱀독 단백질을 억제하는 능력으로 인해(19-21), 모든 분석에서 억제를 위한 대조군으로 사용되었으며 다른 페놀 화합물은 항상 그것과 비교되었습니다.
PLA 2 의 분리
Crotalus durissus cumanensis 독은 Universidad de Antioquia(콜롬비아 메데인)의 serpentarium에 갇혀 있는 4개의 표본에서 얻었습니다. PLA 2 는 Sephadex G-75에 대한 분자 배제 크로마토그래피 및 C-18 컬럼에 대한 역상 HPLC를 통해 0.1% 트리플루오로아세트산(v/v) 중 0 내지 100%의 아세토니트릴의 구배로 1.0mL/분으로 용리하여 정제했습니다. 유출 용액의 흡광도는 280 nm의 파장에서 기록되었습니다(21).
난황을 기질로 사용 하는 포스포리파제 A 2 활성 억제
PLA 2 활성은 Dole(22)에 의해 확립된 방법에 따라 1% Triton ® X-100, 0.1M Tris-HCl, 0.01M CaCl 2 에 현탁된 난황 인지질에서 방출된 유리 지방산의 적정으로 분석되었습니다. , pH 8.5 완충액, PLA 2 15μg/10μL 사용 . 반응 시간은 37℃에서 15분이었다. 활성 곡선의 선형 영역에서 단백질 샘플을 선택했습니다. 억제 실험을 위해 PLA 2 활성 측정 전에 0.5, 1, 2 및 4mM의 각 화합물을 37°C에서 30분 동안 사전 인큐베이션했습니다 . 결과는 억제 백분율로 표시되며, 여기서 100%는 PLA 2 에 의해 유도된 활성입니다.홀로. 탄닌산은 억제를 위한 대조군으로 사용되었습니다. IC50은 반응 선량 곡선의 선형 부분에서 결정되었습니다.
4-nitro-3-octanoyloxy-benzoic acid(4N3OBA)를 기질로 사용한 포스포리파제 A2 활성 억제
선형 기질 4N3OBA를 사용한 효소 활성의 측정은 Holzer and Mackessy(23)에 의해 기술된 방법에 따라 수행되었으며 96-웰 ELISA 플레이트에 맞게 조정되었습니다. 표준 분석에는 200μL의 완충액(10mM Tris-HCl, 10mM CaCl2, 100mM NaCl, pH 8.0), 20μL의 10mM 기질(4NO3BA), 20μL의 샘플(20μg PLA 2 또는 20 )이 포함되었습니다. μg PLA 2 + 각 화합물의 2mM), 물 20μL. 음성 대조군은 버퍼로만 구성되었습니다. PLA에 대한 분자의 억제 효과PLA 2활성은 37°C에서 30분 동안 각 화합물과 효소의 동시 인큐베이션을 통해 결정되었습니다. 인큐베이션 기간 후, 샘플을 검정에 첨가하고 반응을 37℃에서 40분 동안(10분 간격으로) 425 nm에서 모니터링하였다. 방출된 발색단(4-nitro-3-hydroxy benzoic acid)의 양은 효소 활성에 비례하였으며, 초기 속도(Vo)는 20분 직후 측정된 흡광도를 고려하여 계산하였다. 탄닌산은 억제를 위한 대조군으로 사용되었습니다.
세포독성 활성 억제
정제된 PLA 2 의 세포독성 활성 및 억제는 이전에 기술된 바와 같이 96-웰 플레이트에서 성장한 C2C12 s 골격근 근모세포(ATCC CRL-1772)에서 얻은 쥐의 근관에서 분석되었습니다(24). PLA 2 에서 얻은 독소 단독 또는 IC50과 동일한 농도의 화합물과 혼합활성 억제 분석을 37°C에서 30분 동안 인큐베이션했습니다. 그런 다음, 150μL의 분취량(Dubelcco의 Modified Eagle 배지에 희석된 20μg의 독소 + 화합물 포함)을 배양물에 적용했습니다. 37°C에서 3시간 후, 운동 분석(Wiener LDH-P UV)을 사용하여 손상된 세포에서 방출된 젖산 탈수소효소 활성(LDH; EC 1.1.1.27)의 측정을 위해 상등액 분취액을 수집했습니다. 탄닌산은 억제를 위한 대조군으로 사용되었습니다. 추가 대조군은 독소가 없는 상태에서 화합물과 함께 인큐베이션된 세포로 구성되었습니다. 결과는 독소 및 배양 배지를 각각 활성의 100 및 0%로 고려하여 억제 백분율로 표시됩니다.
분자 도킹 및 물리화학적 특성
Molegro Virtual Docker(MVD)를 사용하여 분자 도킹을 수행했습니다(25). MVD는 차동 진화 알고리즘을 기반으로 합니다. 도킹 스코어링 기능, E 스코어 ; 그리고 알고리즘의 솔루션은 리간드와 단백질 사이의 분자간 상호작용 에너지의 합(E inter )과 리간드의 분자내 상호작용 에너지(E intra )를 고려합니다. ACD/Labs의 소프트웨어인 ChemSketch 12.0을 사용하여 화합물 구조를 구축하고 최소화했으며 http://www.acdlabs.com/download/chemsketch/download.html 에서 사용할 수 있습니다 . Crotalus durissus terrificus 의 PLA 2 (PDB 코드 2QOG) 의 구조 이는 C 의 PLA 2 와 57%의 상동성을 나타냈습니다 . d. 본 연구에 사용된 cumanensis (21)는 물 분자 없이 업로드되었습니다. 필요한 경우 결합, 결합 차수, 혼성화 및 수소 원자가 추가되고 전하가 할당되고(Ca 이온에 대해 +2의 형식 전하) 리간드의 유연한 비틀림이 감지되었습니다. 그런 다음 자동 절차를 사용하여 가능한 결합 공동을 감지했습니다. 이 과정에서 캐비티의 최대 수는 5로 고정되었고 그리드 분해능은 0.80Å, 프로브 크기는 1.2Å였습니다. 다른 매개변수는 기본값으로 설정되었습니다. 두 개의 공동이 감지되었으며 촉매 부위 주변의 공동(부피가 약 80.38 Å 3)은 검색 알고리즘으로 MolDock-Optimizer를 사용하여 도킹 계산에 사용되었습니다. 도킹하는 동안 그리드 해상도는 0.3Å으로 설정되었고 결합 사이트 반경은 14Å로 설정되었습니다. 다중 클러스터 포즈에 대한 RMSD 임계값은 < 1.00 Å로 설정되었습니다. 도킹 알고리즘은 심플렉스 진화 모집단 크기가 50이고 최소 실행이 10회인 최대 1,500회 반복으로 설정되었습니다. 작은 E 점수 를 가진 리간드 구성선택하고 활성 사이트에서 상호 작용의 시각적 검사를 수행하고 기록했습니다. 예비 구조-활성 관계 연구를 수행하기 위해 http://www.molinspiration 에서 사용할 수 있는 ''분자 특성 및 약물 유사성 계산'' 도구를 사용하여 Molinspiration에서 각 화합물의 여러 물리화학적 특성을 얻었습니다 . com/cgi-bin/properties .
통계 분석
PLA 2 활성 억제 분석에서 각 화합물의 IC50을 결정하기 위해 용량-반응 곡선의 선형 부분을 사용하였고, 단순 선형 회귀 분석을 수행하였다. 동일한 분석에서 화합물과 탄닌산 간의 유의한 차이를 확인하기 위해 양방향 ANOVA를 수행한 후 Bonferron의 테스트를 수행했습니다. 세포독성 억제 분석에서 화합물과 탄닌산의 유의한 차이를 확인하기 위해 ANOVA를 수행한 후 Dunnett's test를 수행했으며 차이는 p < 0.05일 때 유의한 것으로 간주했습니다. TPSA(Topological Polar Surface Area)와 PLA 2 사이의 Spearman 방법을 사용하여 비모수적 상관관계를 수행했습니다.각 화합물의 억제. 모든 경우에 결과는 각 경우에 표시된 n의 평균 ± SEM으로 표시됩니다.
결과 및 논의
근괴사는 뱀에 물렸을 때 흔히 발견되며 뱀 독에 존재하는 가장 중요하고 풍부한 근육 손상 성분 중 하나인 PLA 2 에 의해 발생합니다 . 막 인지질에 대한 이러한 효소의 작용에는 전-염증성 에이코사노이드(26)의 전구체인 아라키돈산과 같은 지방산의 방출; 또한, 이러한 분해는 인지질 이중층(4)의 불안정화로 이어질 수 있습니다.
최근에, 우리는 이 연구에서 사용된 PLA 2 가 무엇보다도 위에서 언급한 효과를 나타냄을 입증했습니다(21). 이 효소는 CB로 알려진 염기성 PLA 2 와 크로타포틴으로 알려진 산성 비효소적 성분 에 의해 형성되는 이종이량체 복합체인 콜롬비아 Crotalus durissus cumanensis 방울뱀 독의 크로톡신 복합체의 성분으로 약리 활성을 증가시킵니다. PLA 2 (효소에 대한 샤페론 단백질로 작용하여 PLA 2 가 비특이적 부위에 결합하는 것을 방지함)(27, 28). 크로톡신은 남아메리카 뱀에게 물린 경우 신경독성, 신부전, 부종, 국소 및 전신 근독성을 유발합니다. Crotalus durissus 방울뱀(29). 그러나 CB 단독으로도 이러한 효과를 유도하며 그림 1F 와 같은 일반적인 특성을 공유하는 그룹 IIA PLA 2 에 속합니다 . 구조는 3개의 긴 α 나선(이 중 2개는 역평행), 2개의 β 날개로 형성됩니다 및 칼슘 결합 루프( 그림 1F). 이 단백질은 119개에서 134개 아미노산 범위의 가변 길이를 가지고 있습니다. 이들의 역평행 α 나선(각각 잔기 37-57 및 90-109)은 N-말단 나선(잔기 1-12)의 도움으로 소수성 채널을 정의합니다. 이 영역은 기질을 활성 부위로 이끕니다. 활성 부위는 His48, Asp49, Tyr52 및 Asp99의 4개 잔기로 구성됩니다. Asp49와 Tyr28, Gly30 및 Gly32의 조합은 칼슘 결합 루프를 형성하며, 이는 촉매 작용 동안 필요한 Ca 2+ 를 조정하는 역할을 합니다. 또한, 인지질 막 이중층의 지질-물 계면에 대한 효소의 흡착을 매개하는 계면 결합 표면이 있습니다(3, 30).
식물의 2차 대사산물인 탄닌은 대부분 수용성 페놀 화합물로 일반적인 페놀 반응을 일으킬 수 있고 알칼로이드, 젤라틴 및 기타 단백질을 침전시킬 수 있습니다(18). 탄닌은 구조에 따라 가수분해성 탄닌, 축합 탄닌 또는 복합 탄닌으로 분류됩니다(18). 가수분해성 탄닌은 3,4,5-트리히드록실 벤조산(갈산)의 에스테르로, 코어 폴리올로 에스테르화되며, 갈로일기는 추가로 에스테르화되거나 산화적으로 가교되어 보다 복잡한 구조를 형성할 수 있습니다. 효소 활성의 의미는 PLA 2 에 의해 유도된 근괴사, 염증 및 신경독성 유도의 핵심 단계입니다 (5, 31, 32). 그림 2 와 같이, tannic acid(억제 대조군)는 PLA 2 활성 의 우수한 억제능을 나타내었다(IC50=0.59mM). 유사하게, 에피갈로테킨갈레이트는 유사한 억제 활성을 나타내었다(IC50 = 0.38mM). 또한, 이 화합물은 사용된 농도에서 탄닌산(억제 대조군)과 관련하여 유의미한 차이를 나타내지 않았습니다. 사용된 최고 농도에서 갈산 및 그 유도체인 프로필갈레이트는 억제 대조군과 관련하여 유의한 차이를 나타내지 않았다. 그들은 각각 1.84mM 및 1.84mM의 IC50 값을 제시했습니다.

대조적으로 신남산 유도체인 ferulic acid와 caffeic acid가 가장 낮은 억제능을 보였다. 그들은 사용된 모든 농도(p > 0.05)에서 탄닌산(억제 대조군)과 관련하여 상당한 차이를 나타냈습니다. 또한, 이들 화합물은 각각 3.93mM 및 1.40mM의 IC50 값을 나타냈습니다.
유사하게, 합성 기질(4N3OBA)이 사용될 때 모든 화합물은 PLA 2 활성을 억제하였다. 그러나, 표 1 에 나타난 바와 같이 , epigallocatechingallate가 가장 우수한 억제능을 나타냈고, ferulic acid가 가장 낮은 억제능을 나타냈다.
독사류/악어류의 독 에는 PLA 2 가 풍부 하고 뱀에 물린 사고 중에 주입된 많은 양의 독으로 인해 이러한 근독은 의심할 여지 없이 근독성 발달의 중심이며, 이는 국소 및 전신 근독성의 두 가지 임상 패턴에서 발생합니다. (33). PLA 2 의 작용돌이킬 수없는 병변과 영향을받는 사지의 절단을 초래할 수 있습니다 (29). 또한, 해독제는 일반적으로 독의 국소 조직 손상 활동에 대해 제한된 효능을 가지고 있음이 입증되었습니다(7). 따라서, 기존의 해독제 치료를 보완하는 데 유용할 수 있는 억제제 및 접근법을 찾을 필요가 있습니다. 이러한 PLA 2 효소 의 근독성을 평가하기 위해 골격근 근모세포/근관의 설치류 계통과 같은 세포 배양의 사용은 생체 내 근독성 활성과 잘 상관관계가 있는 것으로 보입니다(24). 이 상관관계는 PLA 2 에 의해 유도된 세포독성 활성에 대한 페놀 화합물의 억제 능력을 입증하는 데 사용되었습니다 . 그림 3 과 같이, 모든 화합물은 탄닌산(억제 대조군)과 관련하여 유의한 차이를 보였다.
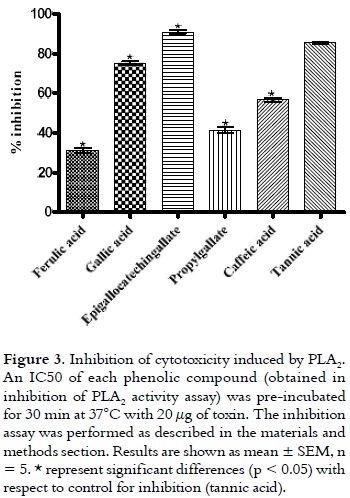
그러나 90.92 ± 0.82 %의 억제로 epigallocatechingallate가 최고의 억제능을 보였다. 가장 낮은 억제 활성은 ferulic acid가 30.96 ± 1.42%로 나타났습니다. 반면 갈산, 프로필갈레이트 및 카페산은 각각 75.20 ± 0.75%, 41.34 ± 1.45% 및 56.50 ± 0.57%의 억제 수준을 나타냈다. 사용된 농도에서 모든 화합물은 근관에 대한 세포독성 효과를 나타내지 않았습니다(데이터는 표시되지 않음).
뱀독 단백질에 대한 비선택적 침전과 이러한 효소에 필요한 보조인자의 킬레이트화 특성은 폴리페놀, 특히 복잡한 구조를 가진 폴리페놀에 기인하는 두 가지 가능한 작용 모드입니다(15, 16, 34, 35). 그러나 분자 도킹 연구를 통해 폴리페놀(예: 클로로겐산, 커큐민, 1,3,5-트리하이드록시 벤젠, 1,3-디하이드록시 벤젠 및 2,4,6-트리하이드록시 아세토페논)이 PLA 2 를 억제한다는 것이 입증되었습니다. 효소 활성 부위와 상호작용함으로써(36, 37). 본 연구에 사용된 폴리페놀에 의한 억제효과의 차이를 설명하기 위해 분자 도킹 분석을 수행하였다. 그림 4 와 같이 , 모든 화합물은 PLA 2 의 활성 부위에서 완벽하게 조정될 수 있습니다.. 또한 모든 폴리페놀은 Asp49와 H-결합 상호작용을 보였다. 이 결합은 칼슘 배위의 불안정화를 촉진할 수 있고, 칼슘 결합 루프에서 이 양이온의 변위를 유발할 수 있습니다. 이는 가수분해될 글리세로인지질의 sn2 결찰을 극성화하는 데 도움이 되기 때문에 효소 활성에 필수적입니다. , 37). 프로필갈레이트를 제외하고 모든 억제제는 글리세로인지질의 가수분해와 관련된 추가적인 기본적인 일반 촉매 메커니즘에 중요한 물 활성화를 차단하는 His48과의 수소 결합을 나타냈습니다(30, 38). 추가적인 H-결합 상호작용은 caffeic acid와 Cys29 사이, 그리고 epigallocatechingallate, Ala23과 Ala102 사이에서 나타났습니다. 더구나, 프로필갈레이트 탄산 측쇄는 Leu6 및 Phe5와 소수성 상호작용을 나타냈다. 마지막으로 노출되면서표 2 에서, MolDock 점수 값은 에피갈로카테킨갈레이트가 가장 강한 상호작용 에너지를 나타내는 반면 갈산은 가장 작은 E 점수 를 나타냄을 보여주었다 ( 표 2 ). 그럼에도 불구하고 갈산이 억제 분석에서 두 번째로 강력한 화합물이기 때문에 이것은 모순된 결과입니다.
PLA 2 의 효소 및 세포독성 효과에 대한 epigallocatechingallate의 최고의 억제 능력은 표 1 에 제시된 물리화학적 특성으로 설명할 수 있습니다 . TPSA는 산소, 질소 및 부착된 수소와 같은 극성 원자의 분자(보통 반 데르 발스) 표면적에 대한 기여의 합입니다(39). TPSA는 대부분의 표적 수용체( 이 경우 PLA 2 ) 와 결합하는 데 필요한 표면적을 나타냅니다 . 그림 5 와 같이, TPSA와 IC50 값 사이의 비모수 상관 분석을 수행한 경우 유의한 상관 관계가 관찰되었습니다(p = 0.0491, r = -0.8079(-0.9878~-0.2593)). 텔로머라제와 아로마타제를 억제하는 다른 폴리페놀 화합물(플라보노이드 및 이소플라본)에서도 유사한 결과가 얻어졌습니다(40). 에피갈로카테킨갈레이트의 H 결합 공여체 및 수용체 패턴은 의심할 여지 없이 고려해야 할 또 다른 특성입니다. 이러한 도너 및 억셉터는 물 분자로부터 수소 결합을 제공/수용하고 구조에 극성을 추가함으로써 수용성의 기여에 중요한 역할을 하는 것으로 알려져 있습니다. 그들은 또한 약물-수용체 상호작용에서 중요한 역할을 합니다. Epigallocatechingallate는 수소 결합 상호 작용을 형성하는 능력이 뛰어나 PLA에 높은 친화력을 제공합니다.2 ( 표 2 에 나타난 바와 같이 , E inter 값). 따라서 이 화합물은 효소에 대한 가장 낮은 상호작용 에너지(affinity)를 나타내었다. 그리고 이 분자는 또한 4개의 회전 가능한 결합을 가지고 있어 PLA 2 와 상호작용할 수 있는 더 많은 자유도를 제공할 수 있으므로 안정적인 복합체를 형성할 가능성이 더 많습니다. 사실, 이것은 에피갈로카테킨갈레이트( 표 2 ) 가 나타내는 내부 에너지의 가장 높은 값에 의해 뒷받침됩니다 .

플라보노이드와 같은 폴리페놀 화합물은 이미 PLA 2 억제제로 보고되었습니다(41). 폴리페놀(예: rosmarinic acid, aristolochic acid 및 α-tocoferol(비타민 E))도 뱀 독으로부터 PLA 2s를 억제 했습니다 (17, 42, 43). 또한 ferulic acid, caffeic acid 및 gallic acid는 전체 뱀 독에 의해 유발되는 활동에 대한 억제 능력을 나타냅니다(15, 44). 그러나 이러한 화합물은 정제된 PLA 2 s 에서 평가되지 않았습니다 . 또한, 이 연구의 결과에서 프로필갈레이트와 에피갈로카테킨갈레이트는 항근육독성 잠재력을 가진 두 가지 새로운 천연 제품이라는 결론을 내릴 수 있습니다.
결론
물린 부위에서 식물 추출물과 다양한 형태(특히 찜질, 스팀, 목욕 등)의 기타 물질을 사용하는 것은 여러 국가의 전통 의학에서 사용되는 일반적인 전략입니다(10, 11). 그러나 이러한 관행 중 일부의 효능은 통제된 분석에서 평가되지 않았습니다. 이 연구에서 다른 식물에 존재하는 일부 폴리페놀은 뱀독 PLA2에 의해 유도된 다양한 활동을 억제하는 것으로 나타 났습니다 . 이 식물 폴리페놀을 물린 부위에 직접 국소 적용하면 어느 정도 원하는 항독 효과, 특히 일반적으로 해독제 투여로는 치료할 수 없는 근독성 예방을 생성해야 합니다. 그러나 생체 내 에서 더시험관 내 결과 를 확인하기 위해 조사가 필요합니다 .
감사의 말
저자는 일반적으로 기술적인 도움을 준 Paola Rey Suarez에게 감사드립니다. 또한 덴마크 오르후스 대학의 Molegro Virtual Docker에 대한 트레일 라이선스를 부여해 주신 Dr. Rene Thomsen에게도 감사드립니다. 이 프로젝트는 Universidad de Antioquia와 COLCIENCIAS(프로젝트 393-2006)에 의해 부분적으로 지원되었습니다.
참조
1. 심슨 ID, Norris RL. 세계적인 뱀에 물린 위기 - 공중 보건 문제는 무시되지 않고 오해되고 있습니다. 야생 환경 메드. 2009년 3월; 20(1): 43-56. [ 링크 ]
2. Markland FS Jr. Snake Venoms. 약제. 1997년; 54(보조 3): 1-10. [ 링크 ]
3. 6명의 DA, Dennis EA. 포스포리파제 A 2 효소 의 확장 슈퍼패밀리 : 분류 및 특성화. Biochim Biophys Acta. 2000년 10월 31일; 1488 (1-2): 1-19. [ 링크 ]
4. 키니 RM. 앞으로의 흥분: 뱀독 포스포리파제 A 2 효소의 구조, 기능 및 메커니즘. 독소. 2003년 12월 42(8): 827-840. [ 링크 ]
5. Gutierrez JM, Ownby C. 독 포스포리파제에 의해 유도된 골격근 변성 A 2 : 국소 및 전신 근독성 메커니즘에 대한 통찰력. 독소. 2003년 12월 15일; 42(8): 915-931. [ 링크 ]
6. Soares AM, Giglio JR. 뱀 독에서 포스포리파제 A 2 의 화학적 변형 : 촉매 및 약리학적 특성에 대한 영향. 독소. 2003년 12월 42(8): 855-68. [ 링크 ]
7. Bon C. 혈청 - 치료법은 100년 전에 발견되었습니다. 독소. 1996년 2월 1일; 34(2): 142-143. [ 링크 ]
8. Gutierrez JM, Leon G, Rojas G, Lomonte B, Rucavado A, Chaves F. Bothrops asper (terciopelo) 뱀 독 으로 인한 국소 조직 손상의 중화 . 독소. 1998년 11월; 36(11): 1529-1538. [ 링크 ]
9. Martz W. 뱀에 물린 것에 대한 평판이 좋은 식물. 독소. 1992년 10월; 30(10): 1131-1142. [ 링크 ]
10. 콜롬비아 북서부 지역의 Otero R, Nunez V, Jimenez S, Fonnegra R, Osorio R, Garcia ME, Diaz A. Snakebites 및 민족 식물학. 파트 II: Bothrops atrox 독 의 치사 및 효소 효과 중화 . J Ethnopharmacol. 2000년 8월; 71(3): 505-511. [ 링크 ]
11. Coe FG, Anderson GJ. 동부 니카라과의 뱀에 물린 민족 약전. J Ethnopharmacol. 2005년 1월 4일; 96(1-2): 303-323. [ 링크 ]
12. Nunez V, Castro V, Murillo R, Ponce-Soto LA, Merforf I. Piper umbellatum 및 Piper peltatum 추출물이 Bothrops 뱀 독의 근독성 포스포리파제 A 2 에 대한 억제 효과 : 활성 성분으로 4-nerolidylcatechol의 분리. 식물화학. 2005년 5월; 66(9): 1017-1025. [ 링크 ]
13. Soares AM, Ticli FK, Marcussi S, Lourenco MV, Januario AH, Sampaio SV, et al . 뱀 독에 대한 억제 특성을 가진 약용 식물. Curr Med Chem. 2005년; 12(22): 2625-2641. [ 링크 ]
14. Marcussi S, Sant'Ana CD, Oliveira CZ, Rueda AQ, Menaldo DL, Beleboni RO, et al . 뱀 독 포스포리파제 A 2 억제제: 의약 화학 및 치료 가능성. Curr Top Med Chem. 2007년; 7(8): 743-756. [ 링크 ]
15. Pithayanukul P, Ruenraroengsak P, Bavovada R, Pakmanee N, Suttisri R, Saen-oon S. 식물 폴리페놀에 의한 Naja kaouthia 독 활성 억제. J Ethnopharmacol. 2005년 3월 21일; 97(3): 527-533. [ 링크 ]
16. Leanpolchareanchai J, Pithayanukul P, Bavovada R, Saparpakorn P. 뱀 독에 대한 태국 망고 종자 커널 추출물의 분자 도킹 연구 및 항 효소 활성. 분자. 2009년 8월 27일; 14(4): 1404-1422. [ 링크 ]
17. Ticli FK, Hage LIS, Cambraia RS, Pereira PS, Magro AJ, Fontes MRM 등 Cordia verbenacea (Boraginaceae) 의 새로운 뱀 독 포스포리파제 A 2 억제제 인 Rosmarinic acid : 항혈청 작용 강화 및 분자 상호 작용. 독소. 2005년 9월 1일; 46(3): 318-327. [ 링크 ]
18. Haslam E. 약물로서의 천연 폴리페놀(식물성 탄닌): 가능한 작용 방식. J Nat Prod. 1996년 2월; 59(2): 205-215. [ 링크 ]
19. Pithayanukul P, Ruenraroengsak P, Bavovada, R, Pakmanee N, Suttisri, R. 시험관 내 . Naja kaouthia 의 활성에 대한 Tannic Acid의 보호 효과 조사 . 독액. Pharm Biol. 2007년 2월 1일; 45(2): 94-97. [ 링크 ]
20. Kuppusamy UR, Das NP. 쥐의 Crotalus adamenteus 피하 중독에 대한 탄닌산 및 관련 천연 화합물의 보호 효과 . 파마콜 톡시콜. 1993년 4월-5월; 72(4-5): 290-295. [ 링크 ]
21. Pereanez JA, Nunez V, Huancahuire-Vega S, Marangoni S, Ponce-Soto LA. Crotalus durissus cumanensis 의 크로톡신 복합체에서 PLA 2 의 생화학적 및 생물학적 특성 규명 . 독소. 2009년 4월; 53(5): 534-542. [ 링크 ]
22. 돌 부사장. 혈장 내 비에스테르화 지방산과 포도당 대사의 관계. 제이클린 인베스트. 1956년 2월; 35(2): 150-154. [ 링크 ]
23. Holzer, M, Mackessy, SP. 뱀독 포스포리파아제 A 2 의 수성 종말점 분석 . 독소. 1996년 10월; 34(10): 1149-1155. [ 링크 ]
24. Lomonte B, Angulo Y, Rufini S, Cho W, Giglio JR, Ohno M, et al. 시험관 내 에서 마우스 내피(tEnd) 및 골격근(C2C12) 세포 에 대한 근독성 포스포리파제 A 2 의 세포용해 활성에 대한 비교 연구 . 독소. 1999년 1월; 37(1): 145-158. [ 링크 ]
25. Thomsen R, Christensen MH. MolDock: 고정밀 분자 도킹을 위한 새로운 기술. J Med Chem. 2006년 4월 29일; 49(11): 3315-3321. [ 링크 ]
26. Murakami M, Kudo T. 분비 포스포리파제 A 2 . 바이오약품 황소. 2004년 8월 10일; 27(8): 1158-1164. [ 링크 ]
27. Habermann E, Breithaupt H. 크로톡신 복합체: 생화학적 및 약리학적 단백질 보완의 예. 톡시콘 1978; 16(1): 19-30. [ 링크 ]
28. Hendon RA, Fraenkel-Conrat H. 크로톡신의 두 가지 구성 요소의 생물학적 역할. Proc Natl Acad Sci USA. 1971년 7월; 68(7): 1560-1563. [ 링크 ]
29. Meier J, White J(Ed.). 동물, 독 및 독의 임상 독성학 핸드북. 플로리다주 보카 레이턴: CRC Press; 1995. Fan HW, Cardoso JLC. 남아메리카에서 뱀에 물린 임상 독성학; 피. 667-688. [ 링크 ]
30. Kini, R (Ed.). 독 포스포리파제 A 2 효소: 구조, 기능 및 메커니즘. 치체스터: John Wiley & Sons; 1997. Scott D. Phospholipase A 2 : 구조 및 촉매 특성; 피. 97-128. [ 링크 ]
31. Teixeira CF, Landucci EC, Antunes E, Chacur M, Cury Y. 뱀 독 근독성 포스포리파제의 염증 효과 A 2 . 독소. 2003년 12월 15일; 42(8): 947-962. [ 링크 ]
32. Montecucco C, Gutierrez JM, Lomonte B. 뱀 독 포스포리파제 A 2 근독 및 신경독에 의해 유도된 세포 병리: 작용 기전의 일반적인 측면. 세포 몰 생명 과학. 2008년; 65(18): 2897-2912. [ 링크 ]
33. Bon, C, Goyffon, M(Eds.). Envenoming 및 치료. 리옹: 재단 Marcel Merieux; 1996. 워렐, DA. 뱀에 물린 독의 임상적 특징 피. 63-76. [ 링크 ]
34. Pithayanukul P, Leanpolchareanchai J, Bavovada R. 뱀 독으로 인한 국소 조직 손상에 대한 차 폴리페놀의 억제 효과. Phytother 해상도 2010년 1월; 24(보조 1): S56-S2. [ 링크 ]
35. Pithayanukul P, Leanpolchareanchai J, Saparpakorn P. 태국 망고 종자 커널 추출물의 분자 도킹 연구 및 뱀독 메탈로프로테이나제 방지 활성. 분자. 2009년 8월 27일; 14(9): 3198-3213. [ 링크 ]
36. Nirmal N, Praba GO, Velmurugan D. 포스포리파제 A 2 억제제 복합체에 대한 모델링 연구. 인도 J Biochem Bio. 2008년 8월; 45(4): 256-262. [ 링크 ]
37. Da Silva SL, Calgarotto AK, Maso V, Damico DCS, Baldasso P, Veber CL 등 . 폴리히드록시 페놀 화합물에 의한 포스포 홀리파제 A2의 분자 모델링 및 억제 . Eur J Med Chem. 2009년 1월; 44(1): 312-321. [ 링크 ]
38. Berg OG, Gelb MH, Tsai MD, Jain MK. 계면 효소: 분비된 포스포리파제 A 2 -패러다임. Chem Rev. 2001년 9월; 101(9): 2613-2654. [ 링크 ]
39. Ertl P, Rohde B, Selzer P. 단편 기반 기여의 합으로 분자 극성 표면적을 빠르게 계산하고 약물 수송 특성 예측에 적용합니다. J. 메드. 화학 2000년 10월 5일; 43(20): 3714-3717. [ 링크 ]
40. Doerksen RJ, Prasanna S. 토폴로지 극 표면적: 2D-QSAR의 유용한 설명자. Curr Med Chem . 2009년; 16(1): 21-41 [ 링크 ]
41. Lindahl M, Tagesson C. 포스포리파제 A 2 억제제로서의 플라보노이드: 그룹 II 포스포리파제 A 2 의 선택적 억제를 위한 구조의 중요성 . 염증. 1997년 6월; 21(3): 347-356. [ 링크 ]
42. Chandra V, Jasti J, Kaur P, Betzel Ch, Srinivasan A, Singh TP. 알파-토코페롤(비타민 E)에 의한 포스포리파제 A 2 의 특정 억제 및 염증에 미치는 영향에 대한 첫 번째 구조적 증거 : 1.8A 분해능에서 포스포리파제 A 2 와 알파-토코페롤 사이에 형성된 복합체의 결정 구조 . J Mol Biol. 2002년 7월 5일; 320(2): 215-222. [ 링크 ]
43. Chandra V, Jasti J, Kaur P, Srinivasan A, Betzel Ch, Singh TP. 1.7 A 결정 구조에서 식물 알칼로이드 아리스토로크산에 의한 프로스타글란딘 합성을 위한 포스포리파제 A 2 억제의 구조적 기초. 생화학. 2002년 9월 10일; 41(36): 10914-10919. [ 링크 ]
44. Mors WB, Nascimento MC, Pereira BM, Pereira NA. 뱀에 물린 것에 대한 활성 식물 천연물 - 분자 접근. 식물화학. 2000년 11월; 55(6): 627-642. [ 링크 ]
동정보이차 소개
동정보이차는 노반차품 맹해춘추차창과 합작계약 한국총판.
노반차품, 노동지등 검증되고 맛있는 tea를 식약청등 정상통관을 필한후 전해드립니다.
보이차, 백차, 홍차등 명차를 선별하여 다우님들과 춘추차관에서 함께 다회와 시음회등을 진행합니다.
즐겁고 맛있는 차여행을 담는 유투브채널 (차문화TV동정보이차)를 운영합니다.
Shop :https://djpuer.com
tel. 010-2471-4296
대전 서구 둔산북로22 209호 (둔산라이프종합상가)
행사
운남성 차산행 : 맹해춘추차창 방문 차산지 답사체험
차산업탐방 : 광저우 방촌에 있는 노반차품본점과 차박람회등 참관
박람회참가 : 한국내 국제차문화제등 박람회 참가
이벤트
매년 봄차, 가을차등 출시 선주문, 공동구매 등 할인이벤트
박람회참관시 현장할인 등
춘추차관
cafe 춘추차관 (카페춘추)
노반차품 맹해춘추차창 생산 고수차를 다양하게 맛보고 구입할수 있는 카페
카페메뉴를 보시려면 이 링크를 누르세요.
주차 : 본건물 4~6층 , 구입고객 2시간 무료주차 제공
송파위례점
노반차품 정품전문점
청복보이차



갈산 항근독성 활성 및 작용 메커니즘, 뱀독 포스포리파제 A 2 독소 억제제, 약용 식물 Anacardium humile 에서 분리됨
추상적인
뱀에 물린 독은 세계 여러 지역, 특히 열대 및 신열대 국가에서 지속적인 건강 위기의 원인입니다. 이 시나리오는 현재 치료법의 한계를 해결하기 위한 새로운 실용적인 솔루션에 대한 긴급한 필요성을 야기합니다. 현재 연구에서는 Anacardium humile 에서 얻은 근독소 억제제인 갈산 (GA) 의 분리, 식물화학적 특성 및 근독성 억제 메커니즘을 조사 했습니다.. GA의 식별 및 분리는 분석 크로마토그래피 분리를 사용하여 달성되었으며, 이는 GA의 상용 표준 및 문헌 데이터와 호환되는 보유 시간 및 핵 자기 공명 스펙트럼을 갖는 화합물을 나타냅니다. GA 단독으로 Bothrops jararacussu 의 조독 과 두 가지 주요 근독소인 BthTX-I 및 BthTX-II에 의해 유발된 근독성 활성을 억제할 수 있었습니다. 원형 이색성 (CD), 형광 분광법(FS), 동적 광 산란 (DLS) 및 분자 도킹 에 의한 상호 작용 연구는 GA가 BthTX-I 및 II와 복합체를 형성한다는 것을 시사했습니다. 표면 플라즈몬 공명(SPR) 동역학 분석은 GA가 9.146 x 10-7KD 로 BthTX-I에 대해 높은 친화력을 가짐을 보여주었습니다. 종합하면, BthTX-I에 결합하는 GA의 2상태 반응 모드와 CD, FS 및 DLS 분석은 GA가 BthTX-I 및 -II에 대한 올리고머화 및 2차 구조 변화를 유도할 수 있음을 시사합니다GA 및 기타 탄닌은 뱀 독의 독성 효과를 효과적으로 억제하는 것으로 나타났습니다. 여기서 우리는 뱀 독 PLA 22의 새로운 메커니즘을 제안하고 다음과 같은 더 많은 증거를 제시합니다. 해독제 로서의 GA의 잠재력. 관련글링크